《氯气的性质》氯及其化合物PPT课件
第一部分内容:素养目标
1.通过阅读,了解有关“从氯气的发现到氯被确认为一种新元素”的历史进程,感受化学对人类文明进步的贡献,培养实验探究与创新意识。
2.从氯原子结构,特别是最外层电子角度,结合实验探究,认识氯气的强氧化性,培养宏观辨识与微观探析相结合探究物质性质的能力。
3.初步了解次氯酸的弱酸性、强氧化性和不稳定性,结合其漂白性,认识氯气、次氯酸在生产、生活中的应用,增强环保意识,强化自身的社会责任感。
... ... ...
氯气的性质PPT,第二部分内容:课前篇自主预习
知识铺垫
1.你在生活中经常接触到的含氯物质有哪些?
提示食盐、海水、84消毒液、漂白粉等。
2.为什么氯元素被称为“成盐元素”?
提示氯元素是活泼的非金属元素,易与金属元素化合形成盐。
新知预习
一、氯气的发现
18世纪70年代,瑞典化学家舍勒将软锰矿与浓盐酸混合加热制得了氯气,但未确认,直到1810年,英国化学家戴维才确认氯气。
二、氯的存在及氯原子结构
1.氯元素在自然界中主要以NaCl、MgCl2、CaCl2等形式存在于海水、盐湖和盐矿中。
2.氯的原子结构示意图为______,氯原子最外电子层上有7个电子,在化学反应中很容易得到1个电子,使最外层达到8个电子的稳定结构。氯气是很活泼的非金属单质,具有强氧化性。
三、氯气的性质
1.物理性质
温馨提示闻气体的方法是用手在瓶口轻轻扇动,仅使少量气体飘进鼻孔。
2.化学性质
(1)与金属单质反应
温馨提示Cl2是一种强氧化剂,和变价金属反应时,生成最高价态金属氯化物。
(2)与非金属单质反应
纯净的氢气可在氯气中安静地燃烧,发出苍白色火焰,反应生成的气体是HCl,它在空气中与水蒸气结合,呈现雾状。
化学方程式为H2+Cl2 2HCl。
【微思考1】通过氢气在氯气中的燃烧,你对“燃烧”有何新的认识?
提示任何发光、放热的剧烈的化学反应都叫燃烧,燃烧不一定要有氧气参加。
(3)与水反应
①化学方程式为Cl2+H2O=HCl+HClO。
②氯气的水溶液称为氯水,颜色为浅黄绿色。
(4)与碱反应
①与NaOH反应——制漂白液
化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
漂白液的有效成分为NaClO。
②与Ca(OH)2反应——制漂白粉或漂粉精
化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
漂白粉或漂粉精的有效成分为Ca(ClO)2。
3.用途
大量用于制造盐酸、有机溶剂、农药、染料和药品等。
四、次氯酸
1.性质
(1)弱酸性(酸性小于碳酸):NaClO+CO2+H2O=NaHCO3+HClO。
(2)不稳定性:次氯酸不稳定,只存在于水溶液中,见光易分解,化学方程式为2HClO==2HCl+O2↑。
(3)漂白性
【微思考2】氯气本身有无漂白性?
提示氯气本身无漂白性,氯气遇水生成的次氯酸有漂白性。
2.用途
次氯酸可用作棉、麻和纸张的漂白剂。
自主测试
1.判断正误(正确的打“√”,错误的打“×”)。
(1)发生氯气泄漏时,污染区居民应向顺风、低洼处转移,并用湿毛巾护住口鼻。 ( )
(2)过量Fe在Cl2中燃烧生成FeCl2。 ( )
(3)湿润的有色布条遇Cl2褪色,说明Cl2具有漂白性。 ( )
(4)Cl2通入到紫色石蕊溶液中的现象是先变红后褪色。( )
(5)纯净的H2在Cl2中安静燃烧,发出苍白色火焰。 ( )
(6)Cl2与H2O反应生成HCl和HClO,故氯水中无Cl2分子。 ( )
答案(1)× (2)× (3)× (4)√ (5)√ (6)×
2.下列说法中正确的是( )
A.液氯和氯水都含有氯离子
B.氯气和液氯都能使干燥的有色布条褪色
C.盐酸和氯水都含有氯离子
D.盐酸和氯水都能使湿润的有色布条褪色
答案C
解析液氯中只含有Cl2不含Cl-,A项错误;干燥的氯气和液氯均不能使有色布条褪色,B项错误;氯气溶于水后发生反应Cl2+H2O=H++Cl-+HClO,C项正确;盐酸不能使有色布条褪色,D项错误。
... ... ...
氯气的性质PPT,第三部分内容:课堂篇探究学习
氯水的成分及其多重性质
问题探究
1.将氯水滴入NaHCO3溶液中,有何现象?为什么?
提示溶液中产生气泡,因为氯水中的H+与NaHCO3发生反应
2.氯水中加入AgNO3溶液,有什么现象?为什么?
提示溶液中有白色沉淀生成,因为氯水中的Cl-与Ag+发生反应生成AgCl沉淀。
3.氯水在光照条件下,有什么现象?为什么?
提示氯水中有气泡冒出,因为氯水中的HClO在光照条件下分解生成HCl和O2。
4.久置的氯水的成分是什么?应如何保存氯水?
提示因为HClO易分解,久置的氯水的成分是HCl和H2O;氯水应放在棕色瓶中密封保存。
深化拓展
1.氯水的成分
(1)相关化学反应及物质的电离
(2)氯水的成分
①三分子:Cl2、HClO、H2O。
②四离子:H+、Cl-、ClO-、OH-。
2.氯水的性质
氯水成分的多样性决定了其性质的多重性:
3.新制氯水、久置氯水、液氯的比较
素能应用
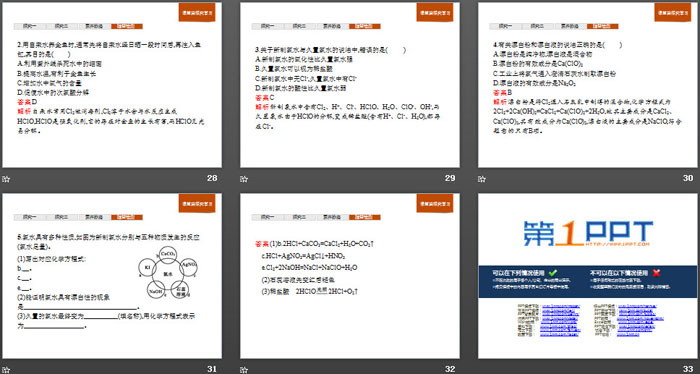
典例1在新制氯水含有的各种微粒中:
(1)使氯水呈浅黄绿色的是__________(填化学式或离子符号,下同)。
(2)能使AgNO3溶液产生白色沉淀的是__________。
(3)能使紫色石蕊溶液显红色的是__________。
(4)能使红色石蕊试纸褪色的是__________。
(5)能使无水CuSO4变蓝的是__________。
(6)能与NaHCO3溶液反应放出气体的是______。
答案(1)Cl2 (2)Cl- (3)H+ (4)HClO (5)H2O
(6)H+
解析根据新制氯水的成分进行分析,其中使红色石蕊试纸褪色的是HClO而非Cl2。
变式训练1在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是( )
A.新制氯水使红玫瑰变为白玫瑰,说明有Cl2
B.加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-
C.将KHCO3固体加入新制的氯水中,有气泡产生,说明有HClO
D.光照新制氯水有气泡逸出,该气体一定是Cl2
答案B
解析A项,新制氯水中因含HClO而具有漂白性,Cl2没有漂白性;C项,氯水中的盐酸与KHCO3反应产生CO2;D项,光照下氯水中的HClO发生分解反应产生O2。
... ... ...
氯气的性质PPT,第四部分内容:随堂检测
1.下列说法中不正确的是( )
A.氯气的密度比空气的大
B.氯气是黄绿色气体
C.可用鼻子对着盛有氯气的集气瓶瓶口闻氯气的气味
D.氯气可用于自来水杀菌、消毒
答案C
解析氯气有毒且有强烈的刺激性气味,闻药品气味时不应将鼻子对着瓶口,而是用手在瓶口轻轻扇动,使少量气体飘进鼻孔,C项错误。
2.用自来水养金鱼时,通常先将自来水经日晒一段时间后,再注入鱼缸,其目的是( )
A.利用紫外线杀死水中的细菌
B.提高水温,有利于金鱼生长
C.增加水中氧气的含量
D.促使水中的次氯酸分解
答案D
解析自来水常用Cl2做消毒剂,Cl2溶于水会与水反应生成HClO,HClO是强氧化剂,它的存在对金鱼的生长有害,而HClO见光易分解。
3.关于新制氯水与久置氯水的说法中,错误的是( )
A.新制氯水的氧化性比久置氯水强
B.久置氯水可以视为稀盐酸
C.新制氯水中无Cl-,久置氯水中有Cl-
D.新制氯水的酸性比久置氯水弱
答案C
解析新制氯水中含有Cl2、H+、Cl-、HClO、H2O、ClO-、OH-,而久置氯水由于HClO的分解,变成稀盐酸(含有H+、Cl-、H2O),都存在Cl-。
4.有关漂白粉和漂白液的说法正确的是( )
A.漂白粉是纯净物,漂白液是混合物
B.漂白粉的有效成分是Ca(ClO)2
C.工业上将氯气通入澄清石灰水制取漂白粉
D.漂白液的有效成分是Na2O2
答案B
解析漂白粉是将Cl2通入石灰乳中制得的混合物,化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故其主要成分是CaCl2、Ca(ClO)2,其有效成分为Ca(ClO)2,漂白液的主要成分是NaClO,符合题意的只有B项。
... ... ...
关键词:人教版高中化学必修一PPT课件免费下载,氯气的性质PPT下载,氯及其化合物PPT下载,.PPT格式;
更多关于《 氯及其化合物 氯气的性质 》PPT课件, 请点击 氯及其化合物ppt氯气的性质ppt标签。
《氯及其化合物》海水中的重要元素—钠和氯PPT(第2课时氯气的实验室制法氯离子的检验):
《氯及其化合物》海水中的重要元素钠和氯PPT(第2课时氯气的实验室制法氯离子的检验) 第一部分内容:学习目标 课程标准 1.能根据反应原理选取实验装置制备氯气。 2.通过实验室制取氯气..
《氯及其化合物》海水中的重要元素—钠和氯PPT(第1课时氯气的性质):
《氯及其化合物》海水中的重要元素钠和氯PPT(第1课时氯气的性质) 第一部分内容:学习目标 课程标准 1.结合真实情景中的应用实例或通过实验探究,了解氯及其重要化合物的主要性质,认..
《氯气的实验室制法 氯离子的检验》氯及其化合物PPT课件:
《氯气的实验室制法 氯离子的检验》氯及其化合物PPT课件 第一部分内容:素养目标 1.回顾初中所学的二氧化碳的实验装置结合实验室制取氯气所用的二氧化锰和浓盐酸的性质选择合适的实验..